Ⅰ. Zvyšte citlivost reakčního systému:
1. Oddělte vysoce kvalitní RNA:
Úspěšná syntéza cDNA pochází z vysoce kvalitní RNA.Vysoce kvalitní RNA by měla zajistit minimálně celkově delší dobu a neobsahuje inhibitory, které neobsahují záznamové enzymy, jako je EDTA nebo SDS.Kvalita RNA určuje maximální hodnotu sekvenční informace, kterou můžete přepsat do cDNA.Obecná metoda čištění RNA je kroková metoda s použitím isookyanátu/acidofenolu.Aby se zabránilo znečištění RNázy, RNA oddělená ze vzorku bohatého na RNázu (jako je pankreas) vyžaduje skladování formaldehydu, aby se ušetřila vysoce kvalitní RNA, což platí ještě více pro dlouhodobé skladování.RNA extrahovaná z krysích jater byla v podstatě degradována po jednom týdnu skladování ve vodě, zatímco RNA extrahovaná z krysí sleziny zůstala stabilní po třech letech skladování ve vodě.Kromě toho jsou transkripty větší než 4 kb citlivější na degradaci stopy RNázy než malé transkripty.Aby se zvýšila stabilita zásobního vzorku RNA, může být RNA rozpuštěna v iontu methalminu a skladována při -70 °C.Thylid používaný k záchraně RNA nesmí obsahovat různé předměty, které degradují RNA.RNA, která pochází ze slinivky břišní, může být uložena v methalaminu po dobu nejméně jednoho roku.Když jste připraveni použít RNA, můžete k vysrážení RNA použít následující metody: přidejte NaCl do 0,2 m a 4násobku objemu ethanolu, umístěte na pokojovou teplotu na 3–5 minut a 10 000 × g odstřeďujte po dobu 5 minut.
2. Použijte reverzní transkriptázu bez aktivity RNaseH (RNaseH-):
Inhibitory RNázy se často přidávají k reverzním transkripčním reakcím, aby se zvýšila délka a výtěžek syntézy cDNA.Inhibitor RNázy se přidává v první reakci řetězové syntézy v přítomnosti pufrů a redukčních činidel, jako je DTT, protože proces pre-cDNA syntézy denaturuje inhibitor, čímž se uvolní navázané RNázy, které degradují RNA.Inhibitor proteinové RNázy pouze zabraňuje degradaci RNA RNázou A, B, C a nebrání RNázám na kůži, proto je třeba dbát na to, aby nedošlo k zavedení RNáz z prstů i přes použití těchto inhibitorů.
Reverzní transkriptáza katalyzuje konverzi RNA na cDNA.Jak M-MLV, tak AMV mají kromě své vlastní polymerázové aktivity endogenní aktivitu RNázyH.Aktivita RNázyH soutěží s polymerázovou aktivitou o heterozygotní řetězce vytvořené mezi RNA templáty a DNA primery nebo cDNA prodlužovacími řetězci a degraduje řetězce RNA:RNA v komplexech DNA.Templáty RNA degradované aktivitou RNázyH již nelze používat jako účinné substráty pro syntézu cDNA, což snižuje výtěžek a délku syntézy cDNA.Eliminace nebo výrazné snížení aktivity RNázyH reverzní transkriptázy by tedy bylo velkým přínosem.
SuperScriptⅡ reverzní transkriptáza, MMLV reverzní transkriptáza RNaseH- a thermoScript reverzní transkriptáza, AMV RNaseH- poskytly více cDNA plné délky než MMLV a AMV.Citlivost RT-PCR je ovlivněna množstvím syntetizované cDNA.ThermoScript je mnohem citlivější než AMV.Velikost produktů RT-PCR je omezena schopností reverzní transkriptázy syntetizovat cDNA, zejména při klonování větších Cdna.Ve srovnání s MMLV SuperScripⅡ významně zvýšil výtěžnost dlouhých RT-PCR produktů.Reverzní transkriptáza RNaseH- také zvyšuje tepelnou stabilitu, takže reakce může být prováděna při teplotách vyšších, než je obvyklé, 37-42 °C.Za navrhovaných podmínek syntézy byly použity oligo(dT) primery a 10uCi [alfa-p]dCTP.Celková produkce prvního řetězce byla vypočtena pomocí TCA precipitační metody.cDNA plné délky byla analyzována za použití odstranění proužků podle velikosti a počítání v alkalickém agarózovém gelu.
3. Zvyšte teplotu uchování tepla reverzní transkripce:
Vyšší udržovací teplota pomáhá otevřít sekundární strukturu RNA a zvýšit výtěžek reakce.U většiny RNA templátů, udržování RNA a primeru při 65 °C bez pufru nebo soli a jejich rychlé ochlazení na ledu eliminuje většinu sekundárních struktur a umožňuje primery navázat.Některé šablony však stále mají sekundární strukturu, a to i po tepelné denaturaci.Amplifikace těchto obtížných templátů může být provedena pomocí ThermoScript reverzní transkriptázy a umístěním reakce reverzní transkriptázy při vyšších teplotách pro zlepšení amplifikace.Vyšší udržovací teploty mohou také zvýšit specificitu, zvláště když se syntéza cDNA provádí pomocí genově specifických primerů (GSPS) (viz kapitola 3).Pokud používáte GSP, ujistěte se, že hodnota Tm primeru je stejná jako očekávaná udržovací teplota.Nepoužívejte oligo(dT) a náhodné primery nad 60 °C.Náhodné primery musí být udržovány při 25 °C po dobu 10 minut, než se zvýší na 60 °C.Kromě použití vyšších teplot reverzní transkripce lze specifičnost zlepšit přímým přenosem směsi RNA/primer z teploty denaturace 65 °C na teplotu udržení reverzní transkripce a přidáním předehřáté 2× reakční směsi (syntéza tepelné iniciace cDNA).Tento přístup pomáhá předcházet mezimolekulárnímu párování bází, ke kterému dochází při nižších teplotách.Použití přístroje PCR zjednodušuje mnoho teplotních spínačů potřebných pro RT-PCR.
Tepelně stabilizovaná polymeráza působí jako DNA polymeráza v přítomnosti Mg2+ a RNA polymeráza v přítomnosti Mn2+.Dokáže udržet teplo až do 65℃.Přítomnost Mn2+ během PCR však snižuje věrnost, což činí Tth polymerázu méně vhodnou pro vysoce přesnou amplifikaci, jako je klonování cDNA.Kromě toho je Tth méně účinný při reverzní transkripci, což snižuje citlivost, a protože jeden enzym může provádět reverzní transkripci a PCR, nelze kontrolní reakce bez reverzní transkripce použít k rozlišení amplifikovaných produktů cDNA od produktů kontaminované genomové DNA.
4. Aditivum, které podporuje reverzní transkripci:
Přidání aditiv, včetně glycerinu a DMSO, do první reakce řetězové syntézy může snížit stabilitu dvouvlákna nukleové kyseliny a uvolnit sekundární strukturu RNA.Bez ovlivnění aktivity SuperScriptⅡ nebo MMLV lze přidat až 20 % glycerinu nebo 10 % DMSO.AMV může také tolerovat až 20% glycerolu bez snížení aktivity.Pro maximalizaci citlivosti RT-PCR v SuperScriptⅡ reverzní transkripční reakci lze přidat 10% glycerol a izolovat při 45 °C.Pokud se do PCR přidá 1/10 produktu retrotranskripční reakce, je koncentrace glycerolu v amplifikační reakci 0,4 %, což nestačí k inhibici PCR.
5. Zpracování RNaseH:
Citlivost lze zlepšit ošetřením reakcí syntézy cDNA pomocí RNázyH před PCR.U některých templátů se předpokládá, že RNA v reakci syntézy cDNA brání vazbě amplifikovaných produktů, v takovém případě může ošetření RNázouH zvýšit citlivost.Obecně je ošetření RNázouH vyžadováno pro amplifikaci relativně dlouhého cílového templátu cDNA o plné délce, jako je tuberózní scherózaⅡ s nízkou kopií.Pro tento obtížný templát RNaseH zesílila signál generovaný cDNA syntetizovanou pomocí SuperScriptⅡ nebo AMV.Pro většinu reakcí RT-PCR je ošetření RNaseH volitelné, protože krok denaturace PCR izolovaný při teplotě 95 °C typicky hydrolyzuje RNA z komplexu RNA:DNA.
6. Vylepšené metody pro detekci malého množství RNA:
RT-PCR je zvláště náročná, když jsou dostupná pouze malá množství RNA.Přidání glykogenu jako nosiče během separace RNA pomáhá zvýšit výtěžnost malých vzorků.Současně s Trizolem lze přidat glykogen bez obsahu RNázy.Glykogen je rozpustný ve vodě a může zůstat ve vodné fázi s RNA, aby napomáhal následnému srážení.Doporučená koncentrace glykogenu bez RNázy je 250 μg/ml pro vzorky menší než 50 mg tkáně nebo 106 kultivovaných buněk.
Přidání acetylovaného BSA k reverzním transkripčním reakcím pomocí SuperScriptⅡ může zvýšit citlivost a pro malá množství RNA snížení množství SuperScriptⅡ a přidání 40 jednotek inhibitoru nukleázy RnaseOut může zlepšit úroveň detekce.Pokud se při separaci RNA používá glykogen, stále se doporučuje přidání inhibitorů BSA nebo RNázy ke zvrácení transkripčních reakcí pomocí SuperScriptⅡ.
Ⅱ. Zvyšte specificitu RT-PCR
1. syntéza cNDA:
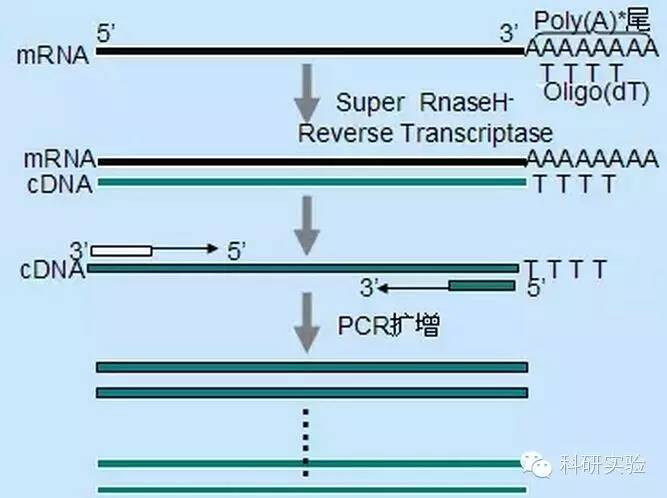
K zahájení syntézy prvního vlákna cDNA lze použít tři různé metody a relativní specificita každé metody ovlivňuje množství a typ syntetizované cDNA.
Metoda náhodného primeru je ze tří metod nejméně specifická.Primery se nasedají na více místech v celém transkriptu za vzniku krátké cDNA s částečnou délkou.Tato metoda se často používá k získání 5′ terminálních sekvencí a cDNA z RNA templátů se sekundárními strukturními oblastmi nebo s koncovými místy, která se reverzní transkriptáza nemůže replikovat.Pro získání nejdelší cDNA je třeba empiricky stanovit poměr primerů k RNA v každém vzorku RNA.Počáteční koncentrace náhodných primerů se pohybuje od 50 do 250 ng na 20 μl reakčního systému.Protože cDNA syntetizovaná z celkové RNA pomocí náhodných primerů je hlavně ribozomální RNA, je obecně jako templát vybrána poly(A)+RNA.
Oligo(dT) iniciace je specifičtější než náhodné primery.Hybridizuje se s poly(A) koncem nacházejícím se na 3' konci mRNA ve většině eukaryotických buněk.Protože poly(A)+RNA tvoří zhruba 1 % až 2 % celkové RNA, množství a složitost cDNA je mnohem menší, než kdyby byly použity náhodné primery.Kvůli své vysoké specificitě oligo(dT) obecně nevyžaduje optimalizaci poměru RNA k primeru a poly(A)+ selekci.Doporučuje se použít 0,5μg oligo(dT) na 20μl reakčního systému.oligo(dT)12-18 je vhodný pro většinu RT-PCR.ThermoScript RT-PCR System poskytuje oligo(dT)20 díky své dobré tepelné stabilitě a je vhodný pro vyšší udržovací teploty.
Genově specifické primery (GSP) jsou nejlepší specifické primery pro krok reverzní transkripce.GSP je antisense oligonukleosid, který může specificky hybridizovat s cílovými sekvencemi RNA, spíše než nasedat všechny RNA jako náhodné primery nebo oligo(dT).Pravidla použitá pro návrh PCR primerů platí také pro návrh reakce reverzní transkripce GSP.GSP může být stejná sekvence jako amplifikační primer nasedající na konci mRNA3', nebo může být GSP navržen tak, aby byl nasedl po směru s reverzním amplifikačním primerem.Pro některé amplifikované objekty je nutné navrhnout více než jeden antisense primer pro úspěšnou RT-PCR, protože sekundární struktura cílové RNA může bránit primeru ve vazbě.Doporučuje se použít 1 pmol antisense GSP v prvním reakčním systému řetězové syntézy o objemu 20 μl.
2. Zvyšte teplotu uchování tepla reverzní transkripce:
Aby bylo možné plně využít GSP specificitu, měla by být použita reverzní transkriptáza s vysokou tepelnou stabilitou.Tepelně stabilní reverzní transkriptáza může být izolována při vyšších teplotách, aby se zvýšila přísnost reakce.Pokud se například GSP nasedá při 55 °C, pak specificita GSP není plně využita, pokud se reverzní transkripce provádí při 37 °C s nízkou přesností za použití AMV nebo M-MLV.SuperScripⅡ a ThermoScript však mohou reagovat při 50 °C nebo vyšších, což eliminuje nespecifické produkty vyráběné při nižších teplotách.Pro maximální specifičnost může být směs RNA/primer převedena přímo z teploty denaturace 65 °C na teplotu udržení reverzní transkripce přidáním předehřáté 2x reakční směsi (tepelná iniciace syntézy cDNA).To pomáhá zabránit párování bází mezi molekulami při nízkých teplotách.Použití přístroje PCR zjednodušuje mnoho teplotních přechodů požadovaných pro RT-PCR.
3. Snižte kontaminaci genomovou DNA:
Jedním z potenciálních problémů s RT-PCR je to, že RNA kontaminuje genomovou DNA.Použití lepších metod separace RNA, jako je Trizol Reagent, snižuje kontaminaci genomové DNA v přípravcích RNA.Aby se zabránilo produktům produkovaným z genomové DNA, může být RNA ošetřena amplifikačním stupněm DnasⅠ, aby se odstranila kontaminovaná DNA před reverzní transkripcí.Vzorky byly udržovány při 65 °C v 2,0 mM EDTA po dobu 10 minut pro ukončení štěpení DNázou*.EDTA chelatuje ionty hořčíku, aby se zabránilo hydrolýze RNA závislé na iontech hořčíku, ke které dochází při vysokých teplotách.
Aby bylo možné oddělit amplifikovanou cDNA od produktu amplifikace genomové DNA, mohou být navrženy primery, které samostatně nasedají se separovaným exonem.Produkty PCR odvozené z cDNA budou kratší než produkty odvozené z kontaminované genomové DNA.Kontrolovaný experiment bez reverzní transkripce se také provádí na každém templátu RNA, aby se určilo, zda daný fragment pochází z genomové DNA nebo cDNA.Produkty PCR získané v nepřítomnosti reverzní transkripce jsou odvozeny z genomu.
Podobný produkt
Snadná RT-PCRᵀᴹJá (Jeden krok)
-Jednostupňová souprava umožňuje provedení reverzní transkripce a PCR ve stejné zkumavce.Potřebuje pouze přidat templátovou RNA, specifické PCR primery a ddH bez RNázy2O.
- Kvantitativní analýzu RNA v reálném čase lze provádět rychle a přesně.
-Souprava používá unikátní reverzní transkripční činidlo Foregene a Foregene HotStar Taq DNA polymerázu v kombinaci s unikátním reakčním systémem pro účinné zlepšení účinnosti amplifikace a specifičnosti reakce.
- Optimalizovaný reakční systém zajišťuje, že reakce má vyšší citlivost detekce, silnější tepelnou stabilitu a lepší toleranci.
-Efektivní schopnost odstranit gDNA, která dokáže odstranit gDNA v šabloně během 2 minut.
-Efektivní systém reverzní transkripce, dokončení syntézy prvního vlákna cDNA trvá pouze 15 minut.
-Komplexní šablony: šablony s vysokým obsahem GC a složitou sekundární strukturou lze také obrátit s vysokou účinností.
-Vysoce citlivý systém reverzní transkripce, šablony na úrovni pg mohou také získat vysoce kvalitní cDNA.
-Reverzní transkripční systém má vysokou tepelnou stabilitu, optimální reakční teplota je 42 ℃ a stále má dobrý reverzní transkripční výkon při 50 ℃.
Čas odeslání: březen-07-2023