PCR (polymerázová řetězová reakce) je jednou z technologií amplifikace DNA in vitro s více než 30letou historií.
Technologie PCR byla průkopníkem Kary Mullis z Cetusu, USA v roce 1983. Mullis požádal o patent PCR v roce 1985 a ve stejném roce publikoval první akademickou práci PCR o vědě.Mullis byl za svou práci oceněn v roce 1993 Nobelovou cenou za chemii.
Základní principy PCR
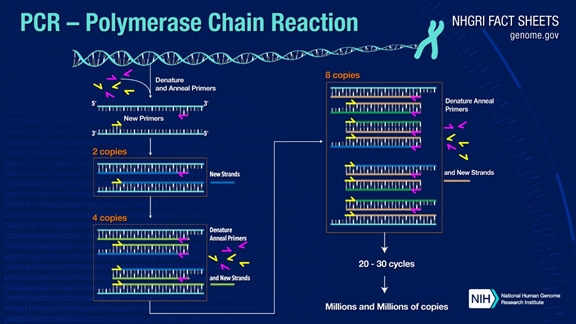
PCR může amplifikovat fragmenty cílové DNA více než milionkrát.Princip je pod katalýzou DNA polymerázy s použitím mateřského vlákna DNA jako templátu a specifického primeru jako výchozího bodu pro prodloužení.Replikuje se in vitro prostřednictvím kroků, jako je denaturace, žíhání a extenze.Proces dceřiného řetězce DNA komplementárního k mateřskému vláknu templátové DNA.
Standardní proces PCR je rozdělen do tří kroků:
1. Denaturace: Použijte vysokou teplotu k oddělení dvouřetězců DNA.Vodíková vazba mezi dvojvlákny DNA se přeruší při vysoké teplotě (93-98 °C).
2.Žíhání: Po oddělení dvouřetězcové DNA snižte teplotu, aby se primer mohl vázat na jednořetězcovou DNA.
3. Prodloužení: DNA polymeráza začne syntetizovat komplementární řetězce podél řetězců DNA z primerů navázaných při snížení teploty.Když je prodloužení dokončeno, cyklus je dokončen a počet fragmentů DNA se zdvojnásobí
Vrácením těchto tří kroků 25-35krát se počet fragmentů DNA exponenciálně zvýší.
Vynalézavost PCR spočívá v tom, že různé primery mohou být navrženy pro různé cílové geny, takže fragmenty cílových genů mohou být amplifikovány v krátkém časovém období.
Dosud lze PCR rozdělit do tří kategorií, a to běžnou PCR, fluorescenční kvantitativní PCR a digitální PCR.
První generace obyčejné PCR
K amplifikaci cílového genu použijte běžný PCR amplifikační přístroj a poté použijte elektroforézu na agarózovém gelu k detekci produktu, lze provést pouze kvalitativní analýzu.
Hlavní nevýhody první generace PCR:
1. Sklon k nespecifické amplifikaci a falešně pozitivním výsledkům.
2. Detekce trvá dlouho a operace je těžkopádná.
3. Lze provést pouze kvalitativní test
Real-Time PCR druhé generace
Real-Time PCR, také známá jako qPCR, používá fluorescenční sondy, které mohou indikovat postup reakčního systému, a monitoruje akumulaci amplifikovaných produktů prostřednictvím akumulace fluorescenčních signálů a posuzuje výsledky pomocí fluorescenční křivky.Lze ji kvantifikovat pomocí hodnoty Cq a standardní křivky.
Vzhledem k tomu, že technologie qPCR probíhá v uzavřeném systému, snižuje se pravděpodobnost kontaminace a fluorescenční signál lze sledovat pro kvantitativní detekci, takže je v klinické praxi nejpoužívanější a stala se dominantní technologií v PCR.
Fluorescenční látky používané ve fluorescenční kvantitativní PCR v reálném čase lze rozdělit na: fluorescenční sondu TaqMan, molekulární majáky a fluorescenční barvivo.
1) Fluorescenční sonda TaqMan:
Během PCR amplifikace se přidává specifická fluorescenční sonda a zároveň se přidává pár primerů.Sonda je oligonukleotid a oba konce jsou označeny reportérovou fluorescenční skupinou a zhášecí fluorescenční skupinou.
Když je sonda intaktní, fluorescenční signál emitovaný reportérovou skupinou je absorbován zhášecí skupinou;během PCR amplifikace 5′-3′ exonukleázová aktivita enzymu Taq štěpí a degraduje sondu, čímž se reportérová fluorescenční skupina a zhášedlo Fluorescenční skupina oddělí, takže fluorescenční monitorovací systém může přijímat fluorescenční signál, to znamená pokaždé, když je amplifikován řetězec DNA, synchronizuje se s tvorbou fluorescenční molekuly, vytvoří se fluorescenční signál a produkt PCR je akumulací
2) Fluorescenční barvivo SYBR:
V reakčním systému PCR se přidá nadbytek fluorescenčního barviva SYBR.Poté, co je fluorescenční barvivo SYBR nespecificky začleněno do dvouvlákna DNA, vyšle fluorescenční signál.Molekula barviva SYBR, která není začleněna do řetězce, nebude emitovat žádný fluorescenční signál, čímž zajistí fluorescenční signál. Nárůst produktů PCR je zcela synchronizován s nárůstem produktů PCR.SYBR se váže pouze na dvouvláknovou DNA, takže křivku tání lze použít k určení, zda je reakce PCR specifická.
3) Molekulární maják:
Jedná se o oligonukleotidovou sondu s dvojitou smyčkou, která tvoří vlásenkovou strukturu s přibližně 8 bázemi na 5 a 3 koncích.Sekvence nukleové kyseliny na obou koncích jsou komplementárně spárovány, což způsobuje, že fluorescenční skupina a zhášecí skupina jsou těsné.Zavřete, nebude produkovat fluorescenci.
Po vytvoření produktu PCR během procesu nasedání se střední část molekulárního majáku spáruje se specifickou sekvencí DNA a fluorescenční gen se oddělí od zhášecího genu, aby se vytvořila fluorescence.
Hlavní nevýhody PCR druhé generace:
Stále chybí citlivost a detekce vzorků s malým počtem kopií je nepřesná.
Je zde ovlivněna hodnota pozadí a výsledek je náchylný k rušení.
Pokud jsou v reakčním systému inhibitory PCR, jsou výsledky detekce náchylné k interferenci.
Digitální PCR třetí generace
Digitální PCR (DigitalPCR, dPCR, Dig-PCR) vypočítává počet kopií cílové sekvence pomocí detekce koncového bodu a může provádět přesnou absolutní kvantitativní detekci bez použití vnitřních kontrol a standardních křivek.
Digitální PCR využívá koncovou detekci a nezávisí na hodnotě Ct (prahová hodnota cyklu), takže digitální PCR reakce je méně ovlivněna účinností amplifikace a je zlepšena tolerance k inhibitorům PCR reakce s vysokou přesností a reprodukovatelností.
Vzhledem k charakteristice vysoké citlivosti a vysoké přesnosti není snadno rušen inhibitory PCR reakce a může dosáhnout skutečné absolutní kvantifikace bez standardních produktů, což se stalo výzkumným a aplikačním hotspotem.
Podle různých forem reakční jednotky ji lze rozdělit do tří hlavních typů: mikrofluidní, čipové a kapkové systémy.
1) Mikrofluidní digitální PCR, mdPCR:
Na základě mikrofluidní technologie je templát DNA separován.Mikrofluidní technologie může realizovat nanoupgradaci vzorku nebo generování menších kapiček, ale kapičky potřebují speciální adsorpční metodu a poté je zkombinovat s reakčním systémem PCR.mdPCR byla postupně přejímána jinými metodami nahrazujícími.
2) Digitální PCR na bázi kapek, ddPCR:
Použijte technologii tvorby kapiček vody v oleji ke zpracování vzorku na kapičky a rozdělte reakční systém obsahující molekuly nukleové kyseliny na tisíce kapiček v nanoměřítku, z nichž každá neobsahuje cílovou molekulu nukleové kyseliny, která má být detekována, nebo obsahuje jednu až několik cílových molekul nukleové kyseliny, které mají být testovány.
3) Digitální PCR na čipu, cdPCR:
Použijte technologii integrované dráhy tekutiny k vyrytí mnoha mikrozkumavek a mikrodutin na křemíkové destičky nebo křemenné sklo a řiďte průtok roztoku různými regulačními ventily a rozdělte vzorek kapaliny na nanometry stejné velikosti do reakčních jamek pro digitální PCR reakci, abyste dosáhli absolutní kvantifikace.
Hlavní nevýhody třetí generace PCR:
Zařízení a činidla jsou drahé.
Požadavky na kvalitu šablony jsou vysoké.Pokud množství templátu překročí množství mikrosystému, nebude možné jej kvantifikovat, a pokud bude příliš malé, sníží se přesnost kvantifikace.
Falešně pozitivní mohou být také generovány, když dochází k nespecifické amplifikaci.
Čas odeslání: 30. července 2021