Výchozí materiál: RNA
Kvantitativní reverzní transkripční PCR (RT-qPCR) je experimentální metoda používaná v PCR experimentech s použitím RNA jako výchozího materiálu.Při této metodě se celková RNA nebo messenger RNA (mRNA) nejprve přepíše do komplementární DNA (cDNA) reverzní transkriptázou.Následně byla provedena qPCR reakce s použitím cDNA jako templátu.RT-qPCR se používá v různých aplikacích molekulární biologie, včetně analýzy genové exprese, ověřování interference RNA, ověřování mikročipů, detekce patogenů, genetického testování a výzkumu nemocí.
Jednokrokové a dvoukrokové metody pro RT-qPCR
RT-qPCR lze provést jednokrokovou nebo dvoukrokovou metodou.Jednokroková RT-qPCR kombinuje reverzní transkripci a PCR amplifikaci, což umožňuje reverzní transkriptáze a DNA polymeráze dokončit reakci ve stejné zkumavce za stejných podmínek pufru.Jednokroková RT-qPCR vyžaduje pouze použití sekvenčně specifických primerů.Ve dvoukrokové RT-qPCR se reverzní transkripce a PCR amplifikace provádějí ve dvou zkumavkách s použitím různých optimalizovaných pufrů, reakčních podmínek a strategií návrhu primerů.
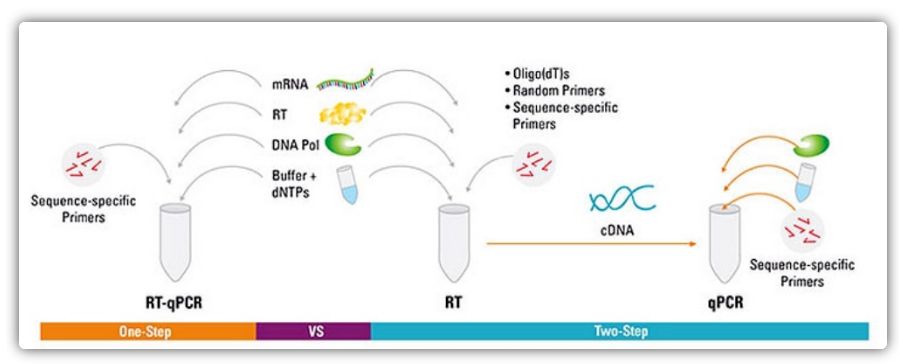
| Výhoda | Nevýhoda | |
| Jeden krok | Tato metoda má menší experimentální chybu, protože obě reakce probíhají v jedné zkumavce
Méně pipetovacích kroků snižuje riziko kontaminace
Vhodné pro vysoce výkonnou amplifikaci/screening, rychlé a reprodukovatelné | Dvoufázové reakce nelze optimalizovat samostatně
Protože reakční podmínky jsou kompromitovány kombinací dvoukrokové reakce, citlivost není tak dobrá jako u dvoukrokové metody.
Počet cílů detekovaných jedním vzorkem je malý |
| Dva kroky | Schopnost vytvářet stabilní cDNA knihovny, které mohou být skladovány po dlouhou dobu a použity ve více reakcích
Cílové geny a referenční geny mohou být amplifikovány ze stejné cDNA knihovny bez potřeby více knihoven cDNA
Reakční pufry a reakční podmínky, které umožňují optimalizaci jednotlivých reakčních běhů
Flexibilní výběr spouštěcích podmínek | Použití více zkumavek a více pipetovacích kroků zvyšuje riziko kontaminace DNA, a časově náročné.
Vyžaduje více optimalizace než jednokroková metoda |
Související produkty:
RT-qPCR Easyᵀᴹ (One Step)-SYBR Zelená I
RT-qPCR Easyᵀᴹ (One Step)-Taqman
RT Easyᵀᴹ I Master Premix pro syntézu prvního řetězce CDNA
Real Time PCR Easyᵀᴹ-SYBR Green I Kit
Selekce celkové RNA a mRNA
Při navrhování experimentu RT-qPCR je důležité rozhodnout, zda použít celkovou RNA nebo purifikovanou mRNA jako templát pro reverzní transkripci.Ačkoli mRNA může být schopna poskytnout mírně vyšší citlivost, stále se často používá celková RNA.Důvodem je to, že celková RNA má jako výchozí materiál důležitější výhodu než mRNA.Za prvé, proces vyžaduje méně purifikačních kroků, což zajišťuje lepší kvantitativní získání templátu a lepší normalizaci výsledků k výchozímu počtu buněk.Za druhé, vyhýbá se kroku obohacení mRNA, což může zabránit možnosti zkreslených výsledků v důsledku různých výtěžků různých mRNA.Celkově vzato, protože ve většině aplikací je relativní kvantifikace cílového genu důležitější než absolutní citlivost detekce, je celková RNA ve většině případů vhodnější.
Primer pro reverzní transkripci
Ve dvoustupňové metodě lze k aktivaci cDNA reakce použít tři různé metody: oligo(dT) primery, náhodné primery nebo sekvenčně specifické primery.Typicky se oligo(dT) primery a náhodné primery používají v kombinaci.Tyto primery nasedají na vlákno templátové mRNA a poskytují reverzní transkriptázu s výchozím bodem pro syntézu.
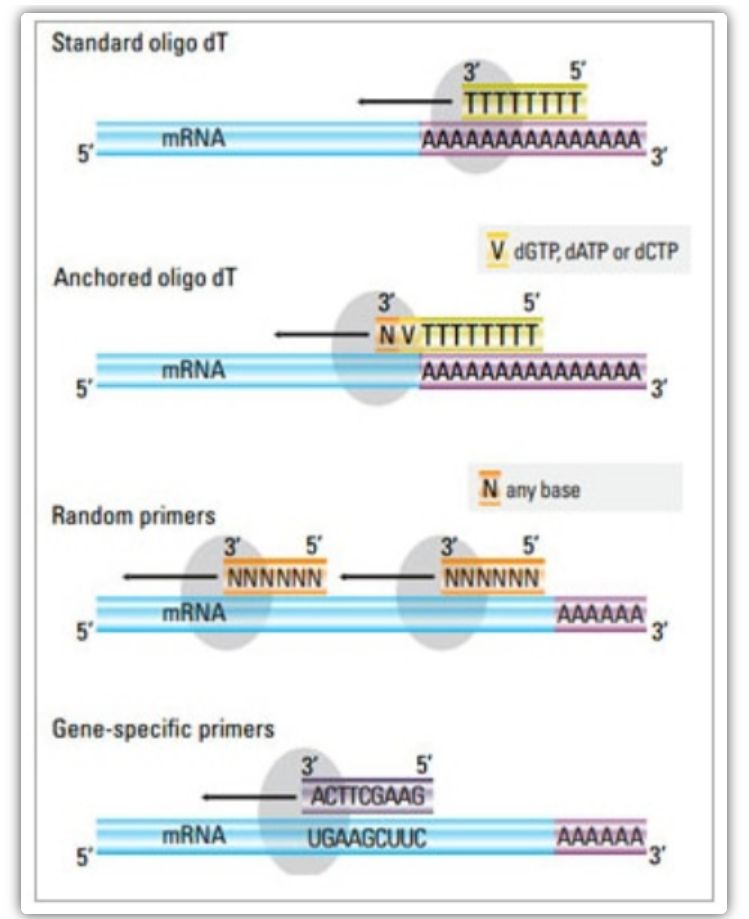
| Výběr primeru | Struktura a funkce | Výhoda | Nevýhoda |
| Oligo(dT) primer (nebo ukotvený oligo(dT) primer) | Rozšířené nasedání na tyminové zbytky na poly(A) konci mRNA;kotvící oligo(dT) primer obsahuje G, C nebo A na 3' konci (kotevní místo) | Syntéza kompletní cDNA z poly(A)-tailed mRNA
Použitelné, když je k dispozici méně výchozího materiálu
Kotevní místo zajišťuje, že se oligo(dT) primer naváže na 5′ poly(A) konec mRNA | Vhodné pouze pro amplifikaci genů s poly(A) ocasy
Získejte cDNA zkrácenou z primárního místa*2 v poly(A)
Předpojaté tak, aby se vázalo na 3′ konec*
*Tato možnost je minimalizována, pokud jsou použity ukotvené oligo(dT) primery |
| náhodný primer
| 6 až 9 bází na délku, které mohou nasednout na více míst během transkripce RNA | Spojte se se všemi RNA (tRNA, rRNA a mRNA)
Vhodné pro transkripty s významnou sekundární strukturou, nebo když je k dispozici méně výchozího materiálu
Vysoký výtěžek cDNA | cDNA je reverzně transkribována ze všech RNA, což obvykle není žádoucí a může zředit signál cílové mRNA
získat zkrácenou cDNA |
| sekvenčně specifické primery | Vlastní primery zacílené na specifické sekvence mRNA | specifická cDNA knihovna
Zlepšete citlivost
Použití primerů reverzní qPCR | Pouze omezeno na syntézu jediného cílového genu |
Reverzní transkriptáza
Reverzní transkriptáza je enzym, který využívá RNA k syntéze DNA.Některé reverzní transkriptázy mají RNázovou aktivitu a mohou po transkripci degradovat řetězce RNA v hybridních řetězcích RNA-DNA.Pokud nemá enzymatickou aktivitu RNázy, lze pro vyšší účinnost qPCR přidat RNázuH.Mezi běžně používané enzymy patří reverzní transkriptáza viru myší leukémie Moloney a reverzní transkriptáza viru ptačího myeloblastomu.Pro RT-qPCR je ideální zvolit reverzní transkriptázu s vyšší termostabilitou, aby mohla být syntéza cDNA prováděna při vyšších teplotách zajišťujících úspěšnou transkripci RNA s vyšší sekundární strukturou, při zachování jejich plné aktivity po celou dobu reakce, což vede k vyšším výtěžkům cDNA.
Související produkty:
Foreasy M-MLV reverzní transkriptáza
Aktivita RNázy H reverzní transkriptázy
RNázaH je schopna degradovat řetězce RNA z duplexů RNA-DNA, což umožňuje účinnou syntézu dvouřetězcové DNA.Při použití dlouhé mRNA jako templátu však může být RNA předčasně degradována, což vede ke zkrácené cDNA.Proto je často výhodné minimalizovat aktivitu RNázyH během klonování cDNA, pokud je požadována syntéza dlouhých transkriptů.Naproti tomu reverzní transkriptázy s aktivitou RNázy H jsou často prospěšné pro aplikace qPCR, protože zvyšují tání duplexů RNA-DNA během prvního cyklu PCR.
Návrh základního nátěru
PCR primery používané pro krok qPCR v RT-qPCR by měly být ideálně navrženy tak, aby pokrývaly spojení exon-exon, kde by amplifikační primer mohl potenciálně překlenout skutečnou hranici exon-intron.Protože sekvence genomové DNA obsahující intron nejsou amplifikovány, tento design snižuje riziko falešně pozitivních amplifikací z kontaminující genomové DNA.
Pokud primery nemohou být navrženy tak, aby oddělily exony nebo hranice exon-exon, může být nutné ošetřit vzorky RNA DNázou I nebo dsDNázou bez RNázy, aby se odstranila kontaminace genomovou DNA.
RT-qPCR ovládání
Do všech experimentů RT-qPCR by měla být zahrnuta negativní kontrola reverzní transkripce (kontrola -RT), aby se zjistila kontaminace DNA (jako je genomová DNA nebo produkty PCR z předchozích reakcí).Tato kontrola obsahuje všechny reakční složky kromě reverzní transkriptázy.Protože u této kontroly nedochází k reverzní transkripci, je v případě pozorování PCR amplifikace nejpravděpodobnější kontaminace DNA.
Čas odeslání: srpen-02-2022








